近日,Elsevier学术期刊《Bioactive Materials》(中科院JCR一区,影响因子14.593)刊发了以我校为第一完成单位的论文“Water-soluble PANI:PSS Designed for Spontaneous Non-disruptive Membrane Penetration and Direct Intracellular Photothermal Damage on Bacteria”(Bioactive Materials, 2021, 6, 4758-4771; dio:10.1016/j.bioactmat.2021.05.019),2018级硕士研究生唐焕峰为该论文的第一作者。
抗生素滥用所导致的细菌耐药性是当今世界面临的最严重的医疗问题之一。与抗生素不同,膜靶向性抗菌剂由于能够破坏细菌的细胞膜结构,而一般具有很低的耐药性,近年来受到了人们的广泛关注。然而,由于真核细胞和细菌细胞膜结构的相似性,膜靶向性抗菌剂很容易对真核细胞的细胞膜也造成破坏,产生不可忽视的真核细胞毒性以及副作用。
细胞壁和细胞膜是细菌的外部屏障,由于细菌DNA位于无核膜保护的拟核中,因此,如果抗菌剂能够以不破坏细胞膜的方式快速穿透细胞膜,就可以在不损伤真核细胞的前提下,直接接触并破坏细菌的DNA,同时避免对正常组织的副作用。
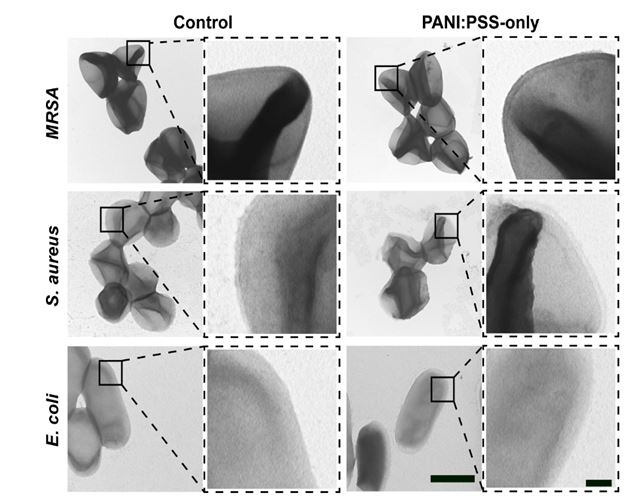
受两亲性穿膜肽的启发,我校材料学院陈克正教授、王玮教授与中国医学科学院放射医学研究所刘鉴峰研究员(材料学院特聘教授)展开合作,利用纳米仿酶催化合成法,制备出一种能够高效无损穿膜的两亲性聚电解质光热抗菌材料PANI:PSS。激光共聚焦荧光成像和细菌透射电镜观察结果表明,经过5分钟孵育就可以检测到细菌细胞内有该材料的绿色荧光信号,随着时间的延长,绿色荧光信号由外及内,逐渐增强(图1)。同时,与空白对照组相比,实验组细菌的细胞膜并未出现凹陷、褶皱或破损等异常现象(图2),充分证明该材料能够以无损伤的方式快速穿透细菌的细胞膜,并可在随后施加的体外近红外光的激发下,在细菌内部产生高热,对细菌DNA造成不可逆的热损伤,进而杀灭细菌。动物活体研究结果表明,该材料能够阻止由超级细菌——耐药金黄色葡萄球菌所引起的小鼠体表伤口感染,且对小鼠正常组织无毒副作用。
综上所述,相较于传统的膜靶向抗菌剂,该研究制备的抗菌剂不仅具有更快的穿膜速率,而且对真核细胞的细胞膜无损伤,避免了对正常组织的副作用,其制备方法也更为简便,成本更低,对解决细菌耐药性问题具有重要意义。此外,这种两亲性无损穿膜抗菌剂的设计思路有望运用到其它抗菌剂的设计中,并在纳米药物的跨膜运输方面具有潜在的应用价值。
文章链接:https://pubs.acs.org/doi/10.1021/acsami.0c22746
本工作得到了国家优青基金、山东省自然科学基金等项目的资助。
图1 DAPI染色的大肠杆菌(E. coli)与PANI:PSS共孵育5~120分钟后所拍摄的激光共聚焦显微镜照片,标尺为5 µm(该图中,红色和绿色荧光分别由DAPI和PANI:PSS发出)。
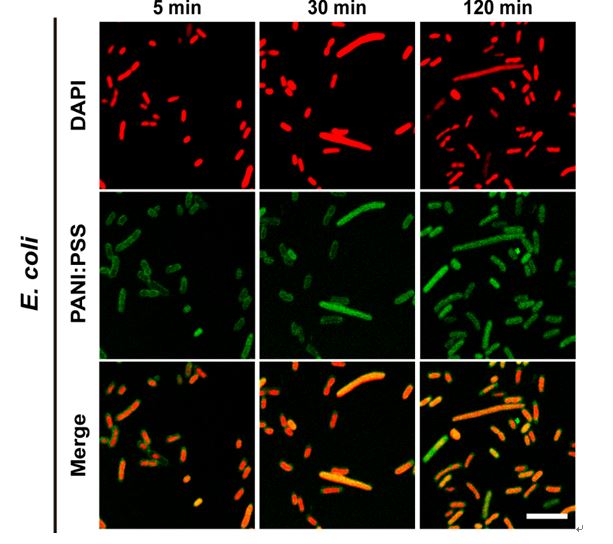
图2金黄色葡萄球菌(S. aureus)、耐甲氧西林金黄色葡萄球菌(MRSA)、和大肠杆菌(E. coli)与PANI:PSS共孵育5~120分钟后所拍摄的透射电子显微镜照片,标尺分别为1 µm(左)和200 nm(右)。